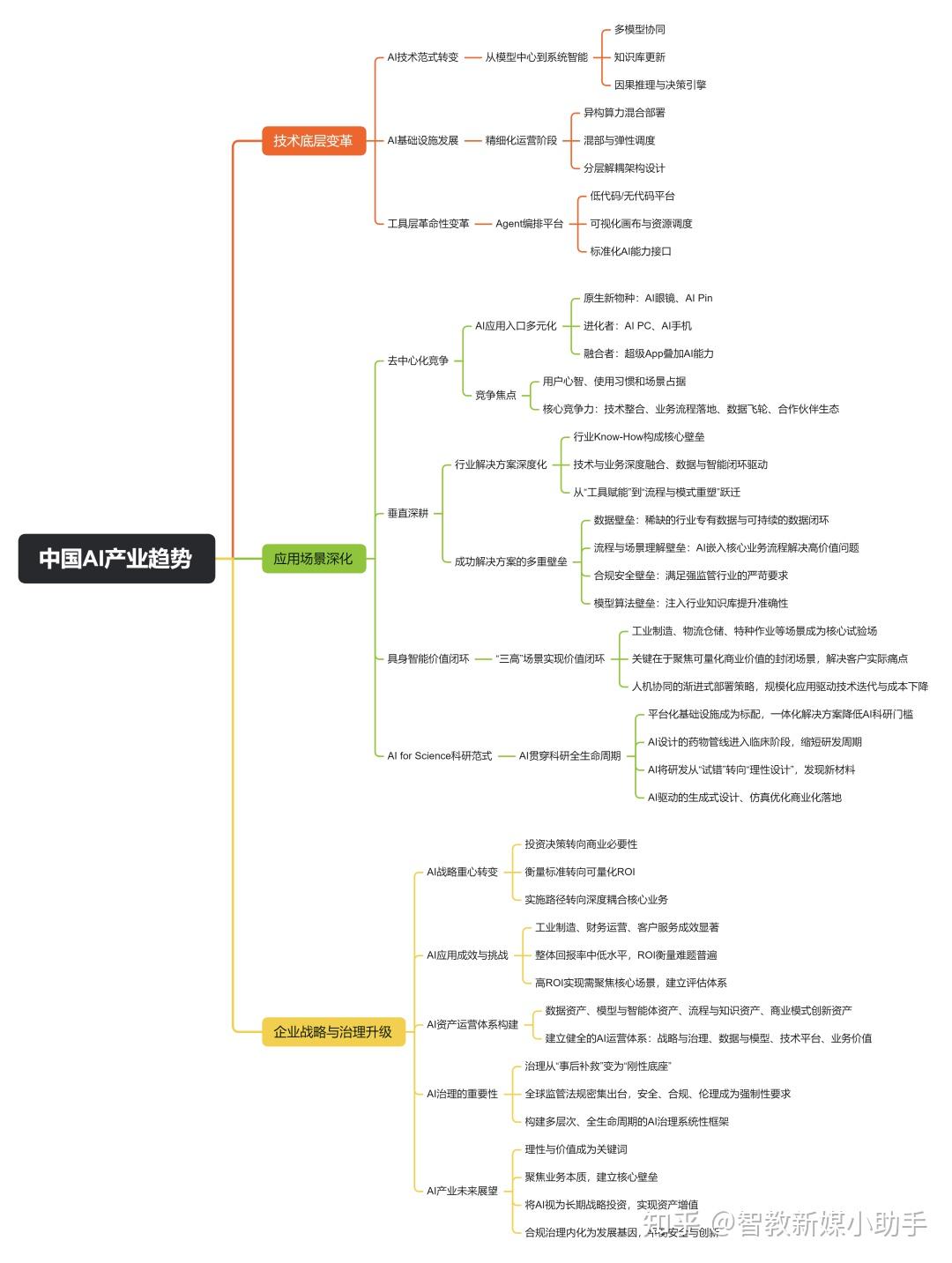
中证报中证网讯(记者 傅苏颖)日前,新修订的《中华人民共和国药品管理法实施条例》(简称《条例》)发布,自2026年5月15日起施行。

《条例》提出,支持以临床价值为导向的药品研制和创新,鼓励研究和创制新药,支持新药临床推广和使用。明确药物非临床安全性评价研究机构资格认定程序,细化药物临床试验管理要求。设立药品上市注册加快程序,明确药品再注册程序,规定处方药、非处方药转换机制。对符合条件的儿童用药品、罕见病治疗用药品给予市场独占期,对含有新型化学成分的药品等进行数据保护。细化药品上市许可持有人的责任。
《条例》强调,加强药品生产管理。严格药品委托生产管理,压实委托生产时药品上市许可持有人的责任,明确可以委托分段生产药品的情形。明确中药饮片、中药配方颗粒生产、销售的管理要求。
《条例》要求,完善药品网络销售管理制度,压实药品网络交易第三方平台提供者责任。加强医疗机构药事管理,保障使用环节药品质量。明确医疗机构配制制剂审批流程,规定医疗机构制剂调剂使用条件和程序,支持配制儿童用医疗机构制剂,满足儿童患者用药需求。
中国药科大学药品监管科学研究院执行院长邵蓉表示,《条例》支持以临床价值为导向的药品研制和创新,切实推动我国从模仿创新向原始创新、从制药大国向制药强国跨越。
邵蓉表示,《条例》明确给予符合条件的罕见病治疗用药品、儿童用药品市场独占期。市场独占期制度是国际通行做法,是为保障患者能够公平地获得健康权而采取的必要政策倾斜,通过排他性权利重新调整分配相关利益,激励产品研发,保证市场供给。聚焦临床实践中儿童用药品种、剂型、规格缺乏等痛点,《条例》明确由国家卫生健康委和国家药监局制定儿童常用医疗机构制剂清单,支持医疗机构配制、使用。为方便老年人、残疾人用药,要求持有人应当按规定提供语音、大字、盲文或者电子等无障碍版本标签、说明书。
中国药品监督管理研究会会长张伟表示,《条例》的核心亮点之一,是将近年来药品审评审批制度改革中行之有效的政策措施制度化、法治化,确立了以临床价值为导向的高效审评审批路径。通过一系列制度设计,为医药产业创新营造了良好的政策环境,旨在持续推动我国从制药大国向制药强国转变。
张伟表示,《条例》明确了突破性治疗药物、特别审批等药品加快上市注册机制。通过构建一个以临床价值为核心、多通道加速的现代化药品审评审批体系,为临床急需的创新药提供明确的加快上市路径,缩短创新研发成果向临床应用的转化时间,既激发企业的创新动力,也有利于患者能尽早享受前沿医药科技的转化成果。
此外,张伟认为,《条例》通过完善和引入药品试验数据保护和市场独占期制度,平衡创新与仿制的关系,营造健康有序的市场竞争环境。
在张伟看来,药品试验数据保护制度是对专利保护的有效补充,不仅有利于增强企业对创新药研发的信心,也平衡了创新与仿制的利益。一方面,创新药企业不必再担心因提交数据而面临被不当利用的风险,另一方面,在保护期限届满后,仿制药可以简化申请上市,促进竞争,降低药价,惠及公众。药品试验数据保护制度通过对药品上市许可持有人自行取得且未披露的试验数据和其他数据实施保护,向企业发出了明确的积极信号,将切实鼓励企业研发创新。
张伟表示,展望未来,随着《条例》的深入实施,将进一步提升我国药品审评审批的质量和效率,加速安全有效的创新药和临床急需药上市,更将提升药品研发质量和强化企业主体责任意识,从而推动中国从制药大国向制药强国稳步迈进,最终惠及亿万患者,切实保障公众健康。
转载请注明:热点财经网 » 金融科技 » 新版《药品管理法实施条例》发布 罕见病和儿童用药享市场独占期
版权声明
本文仅代表作者观点,不代表B5编程立场。
本文系作者授权发表,未经许可,不得转载。